Spread the love


Самым распространенным химическим элементом на нашей планете является углерод. Но в масштабах Вселенной Земля — лишь песчинка среди бескрайнего моря звезд и галактик. И в связи с этим становится интересным, а из чего состоит наша Вселенная? Что является основой далеких планет и астероидов? Какой элемент периодической таблицы самый главный?
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO →ot 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Как соединяются химические элементы в живых организмах?
Группа атомов, удерживаемых энергией в устойчивой ассоциации, называется молекулой или кристаллом. При изучении веществ в живых организмах нам будут встречаться следующие типы химических связей:
- ионные – когда притягиваются атомы с противоположными зарядами;
- ковалентные – характеризующиеся обобщением (перекрытием) в облако пары валентных электронов от разных атомов;
- водородные – связи между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
Ионные связи образуют кристаллы
В обычной поваренной соли – хлориде натрия (NaCl) – атомы удерживаются ионными связями, образуя решётку. Натрий имеет 11 электронов: 2 во внутреннем энергетическом уровне (К), 8 на уровне L и 1 на внешнем уровне М (валентность). Одиночный неспаренный валентный электрон имеет тенденцию к соединению с другим непарным электроном в другом атоме.
Стабильная конфигурация достигается за счёт потери электрона одним атомом и приобретения его другим. Натрий, теряя электрон, становится положительно заряженным ионом – катионом (Na+).
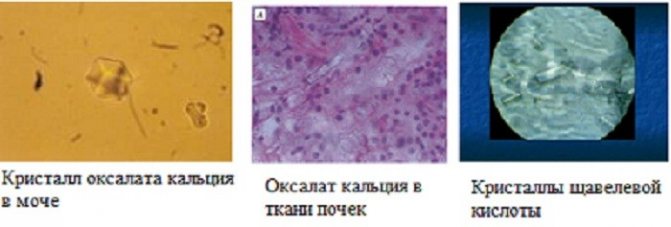

Минеральные соли в клетке накапливаются в виде кристаллов.
У атома хлора 17 электронов: 2 в уровне К, 8 в уровне L и 7 на М-уровне. Одна из орбиталей на внешнем энергетическом уровне содержит неспаренный электрон. Добавление электрона от другого атома превращает атом хлора в отрицательно заряженный хлорид-ион (Cl-). Так как противоположные заряды притягиваются, натрий и хлор остаются связанными нейтральным ионным соединением.
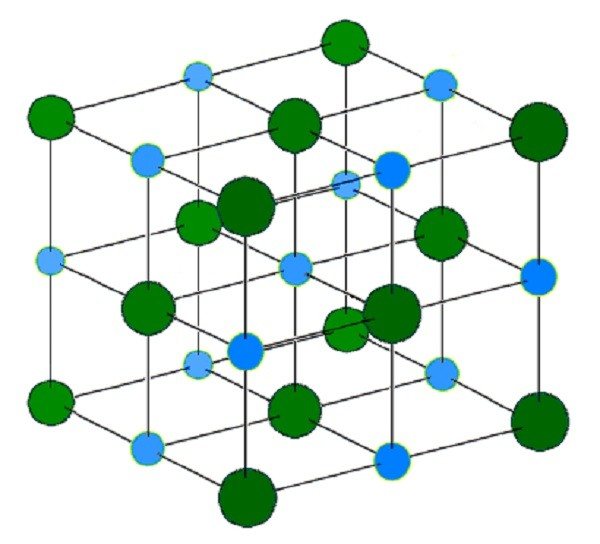

Кристаллическая решётка хлорида натрия. Голубой цвет = Na+ Зелёный цвет = Cl− Автор: H Padleckas
Если кристаллическую решётку соли поместить в воду, электрическое притяжение молекул воды разрушает силы, удерживающие ионные связи. Раствор соли в воде представляет собой смесь свободных катионов натрия (Na+) и анионов хлора (Cl-).
Так как живые системы всегда содержат воду, то ионы для них важнее кристаллов. Многие химические элементы в живых организмах находятся в виде ионов. Необходимые в клеточных системах ионы – это:
- Ca2+, обеспечивающий передачу клеточных сигналов;
- K + и Na +, участвующие в проведении нервных импульсов.
Если совместить металлический натрий и газообразный хлор, реакция образования хлорида натрия будет экзотермической – быстрой и с выделением тепла.
Ковалентные связи соединяют химические элементы в живых организмах и создают стабильные молекулы
Ковалентные связи образуются, когда два атома делят одну или несколько пар валентных электронов. В качестве примера рассмотрим газообразный водород (H2). Каждый атом водорода имеет неспаренный электрон, а значит и незаполненный внешний уровень. По этой причине атом водорода нестабилен. Когда два атома водорода образуют тесную связь, оба валентных электрона притягиваются к их ядрам. Они как бы делят между собой электроны, в результате чего получается двухатомная молекула газообразного водорода.
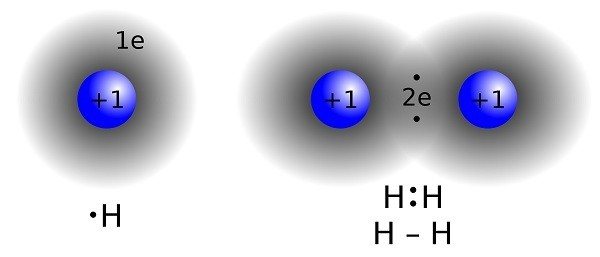

Ковалентная связь, формирующая молекулу водорода H2 (справа), где два атома водорода перекрывают два электрона Автор: Jacek FH, CC BY-SA 3.0
Молекула, образованная двумя атомами водорода, стабильна по трём причинам:
- Она нейтральна, так как содержит 2 протона и 2 электрона.
- Правило октета в ней выполнено. Каждый общий электрон атомов вращается вокруг обоих ядер.
- У них нет неспаренных электронов.
Многие химические элементы в живых организмах образуют ковалентные связи.
Прочность ковалентных связей
Прочность ковалентных связей зависит от количества их общих электронов. В прошлом пункте мы рассматривали одинарную связь, двойная же связь объединяет 2 пары электронов, она более крепкая. Чтобы разорвать её, требуется больше энергии. Самые сильные ковалентные связи – тройные, такие которые объединяют два атома в молекулу газообразного азота (N2).
Ковалентные связи в химических формулах показывают линиями. Каждая линия между атомами представляет собой совместное использование одной пары электронов. Структурная формула газообразного водорода H–H, кислорода O=O, а их молекулярные формулы H2 и O2. Структурный характер формулы для N2 N ≡ N.
Молекулы с несколькими ковалентными связями
Огромное количество биологических соединений состоит более чем из двух атомов. Атом, который требует двух, трёх или четырёх дополнительных электронов для заполнения внешнего уровня, может приобрести их путём обмена с двумя и более атомами. Например, атом углерода (С) содержит шесть электронов, четыре из них находятся на его внешнем энергетическом уровне и не имеют пары. Чтобы удовлетворить правилу октета, атом углерода должен образовать 4 ковалентных связи. Так как эти 4 скрепления могут производиться разными путями, углерод образует множество молекул, например: СО2 (углекислый газ), СН4 (метан), С2Н5ОН (этанол).
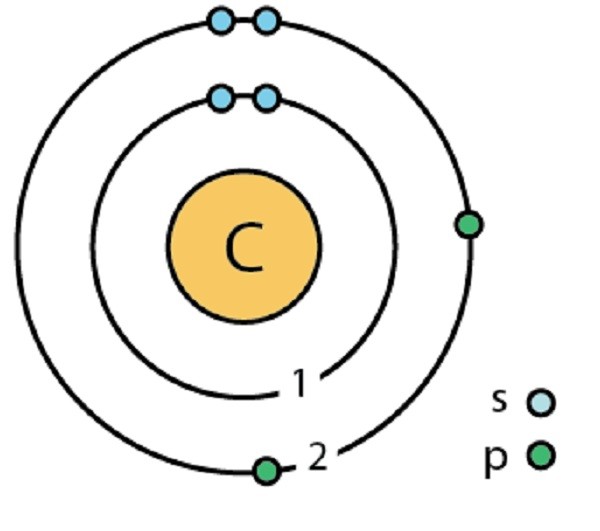

Модель атома углерода Автор: Ahazard.sciencewriter, CC BY-SA 4.0
Полярные и неполярные ковалентные связи
Атомы отличаются количеством электронов, это свойство называется электроотрицательностью. В строке Периодической таблицы она увеличивается вправо и уменьшается книзу колонки, то есть элементы в правом верхнем углу имеют наиболее высокую электроотрицательность.
Для связи между двумя идентичными атомами, например между двумя атомами водорода или кислорода, электроны делятся поровну. Области их соединения называются неполярными. Таковы, например, молекулы Н2, О2.
При соединении значительно отличающихся по электроотрицательности атомов электроны не делятся поровну. Общие электроны, скорее всего, будут ближе к атому с большей отрицательностью, и хотя получившаяся молекула будет электрически нейтральной, заряд в ней распределится неравномерно. Неравномерность заряда приводит к областям частичной отрицательности (в районе наиболее отрицательного атома) и положительного заряда вблизи наименее отрицательного атома. Такие связи называются полярными ковалентными, а молекулы – полярными.
На схемах с изображением полярных молекул эти частичные заряды обозначаются греческой буквой Дельта (δ). Интересно, что хотя С и Н немного отличаются по электроотрицательности, связь между ними неполярна. Н2О – полярная молекула, электроны в ней концентрируются около ядра атома кислорода. О воде мы будем говорить более подробно в следующем уроке.
Происхождение названия
Слово кислород
(именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «
оксиген
» (фр. oxygene), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «
порождающий кислоту
», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Масштабные правительственные программы
- 1990 год – Германия запускает программу «1000 Солнечных крыш».
- 1994 год – Япония активно внедряет кампанию «70000 Солнечных крыш».
- Компания Spectrolab в 2009 году демонстрирует фотоэлемент со способностью преобразовывать энергию Солнца в электричество на 41,6%.
- В 2011 году компания из Калифорнии Solar Junction сумела достичь КПД 43,5%.
- Корпорация Sharp в 2013 году создает фотоэлемент, состоящий из 3-х слоев, на сложной химической базе с 44,4% КПД. А в 2014 Институте им. Фраунгофера создали солнечные батареи с КПД 46%.
- В 2014 году введена в эксплуатацию самая большая на Земле электрическая станция от Солнца – Ivanpah Solar Electric Generating System. Ее площадь 14,24 кв. км, а мощность – 392 МВт. Этого хватит что бы обеспечить больше 140.000 объектов в Калифорнии.
Читай также: Каким был первый пульт для телевизора и кто его придумал


Интересно, что одним из трех совладельцев этой электростанции является компания Google.
Нахождение в природе
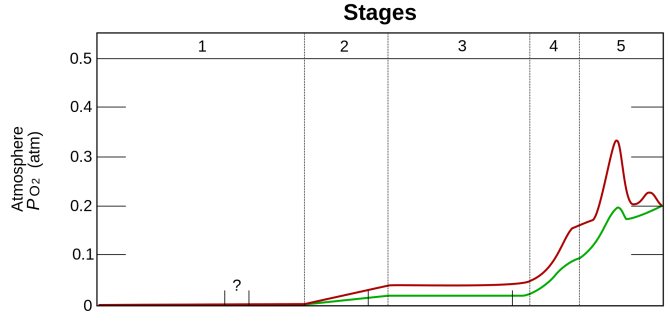

Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка. 1
. (3,85—2,45 млрд лет назад) — O2 не производился
2
. (2,45—1,85 млрд лет назад) O2 производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O2 в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2020 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Сверхтекучесть гелия
Орден Феникса
Практически все атомы вашего тела в свое время побывали в недрах звезд. Многие из них пережили катастрофические взрывы сверхновых, и, более того, некоторые образовались именно в моменты таких взрывов. Мы, как феникс, родились из пепла, но из пепла звезд. Взрывы сверхновых очень важны уже потому, что это эффективный способ выбросить в космос наработанные в звезде элементы. Если итогом взрыва, как это чаще всего бывает, становится нейтронная звезда, в нее превращается только относительно небольшое ядро красного гиганта, состоящее в основном из железа и никеля. Например, при начальной массе звезды в 20 солнечных в нейтронную звезду превратится не более 7% вещества, все остальное выметается взрывом в космос и доступно для формирования новых светил.
Однако поддержанием этого космического круговорота вещества роль сверхновых не исчерпывается. Прямо во время взрыва в них могут образовываться новые элементы. Примерно 10 секунд новорожденная нейтронная звезда успевает побыть «алхимиком». Перед самым взрывом структура массивной звезды подобна луковице. Ядро окружено несколькими оболочками, состоящими из все более легких элементов. В тот самый момент, когда ядро начинает катастрофически сжиматься, превращаясь в нейтронную звезду или черную дыру, по лежащим выше слоям от центра наружу пробегает волна взрывного ядерного горения. В результате химический состав вещества сильно сдвигается в сторону тяжелых элементов.
Считается, что наиболее эффективно обогащают Вселенную тяжелыми элементами звезды с массами от 12 до 25 солнечных. Их железное ядро окружает мощная кремниево-кислородная оболочка, которая после сброса дает элементы от натрия до германия (включая железо). В более массивных звездах слишком много вещества, состоящего из тяжелых элементов, проваливается внутрь черной дыры, и наружу ускользают только достаточно легкие. Звезды поменьше, с массами в 8—12 солнечных, не обладают такой оболочкой, и поэтому элементов группы железа в них образуется мало. Зато… появляются много более тяжелые элементы.
Гомункулус
И вот наконец по прошествии миллиардов лет в гигантской реторте Вселенной сложились условия для того, чтобы смог появиться гомункулус. Жизнь, какой мы ее знаем, не могла бы возникнуть в течение первого миллиарда лет после Большого взрыва — тогда просто не было в достаточном количестве многих необходимых элементов.
Каждая частичка нашего тела прошла через космическое горнило. Часть атомов водорода могла остаться неизменной со времени «первых трех минут», но основная доля составляющих его элементов появилась в звездах на стадии устойчивого термоядерного горения. Многие ядра возникли во время вспышек сверхновых. Другие — были выброшены звездами в виде кружева планетарных туманностей. Возможно, крохотная доля ядер связана со столкновениями космических лучей с веществом межзвездного газа, когда идут интереснейшие «реакции скалывания», в которых быстрая частица выбивает ядра легких элементов. Для появления человека понадобилась целая «лаборатория» космического алхимика.
Состав вещества во Вселенной продолжает медленно изменяться и в наши дни: усилиями триллионов звезд доля элементов тяжелее гелия постепенно растет. Наблюдения показывают, что у звезд с большей «металличностью», то есть содержанием элементов тяжелее гелия, выше вероятность возникновения планетных систем. А значит, химическая эволюция Вселенной пока благоприятствует появлению разумных существ, сделанных из «звездного вещества». И все же стоит помнить, что подобной переработке подвергается лишь малая часть материи во Вселенной. В целом же водород так и останется самым распространенным ее элементом, просто потому, что далеко не все вещество сможет попасть в звезды (например, у межгалактического газа нет такой перспективы). Если же вспомнить, что и это вещество составляет от силы пять процентов на фоне колоссальной массы темной материи и темной энергии, то вы почувствуете, насколько же невероятно повезло в этом тому комочку вещества, который смог оглянуться по сторонам и оценить величие окружающего мироздания.

Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2↑
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца (IV):
2H2O2 →MnO2 2H2O + O2↑
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
Разложение оксида ртути (II) (при t = 100 °C) было первым методом синтеза кислорода:
2HgO →100oC 2Hg + O2↑
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
2H2O →e− 2H2 + O2↑
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Где встречается самый распространенный элемент?
Найти в природе уголок, где не было бы кислорода, практически невозможно. Он везде – и в недрах, и высоко над Землей, и под водой, и в самой воде. Встречается он не только в соединениях, но и свободном состоянии. Скорее всего, именно из-за этого для ученых данный элемент всегда представлял интерес.


Кислород часто используется в промышленности
Геологи и химики занимаются изучением наличия кислорода в соединении со всеми элементами. Ботаникам интересно исследовать процессы питания и дыхания растений. Физиологи до конца не выяснили роль кислорода в жизни животных и человека. Физики стремятся найти новый способ его использования для создания высоких температур.
Известно, что не зависимо от того, жаркий ли это южный воздух либо холодный воздух северных районов, содержание в нем кислорода всегда одинаково и составляет двадцать один процент.


Кислородные коктейли становятся все более популярными
Физические свойства
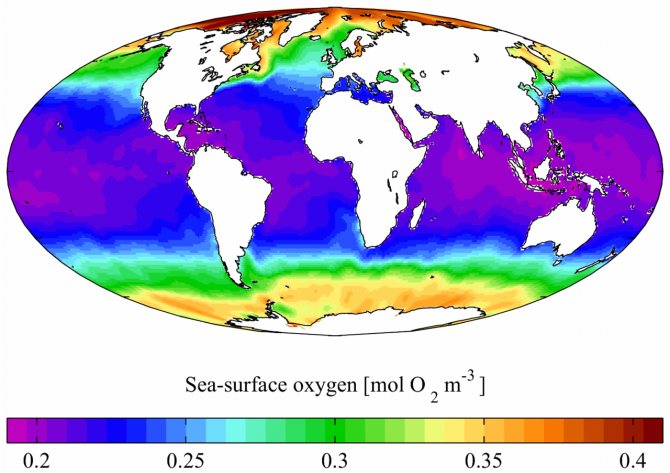

В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой


Жидкий кислород
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
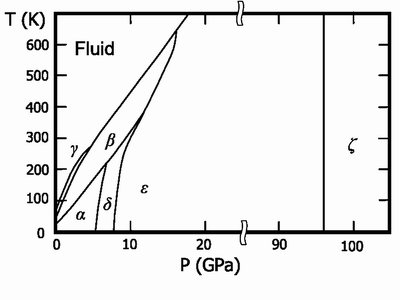

Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы. Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-O2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a
=5,403 Å,
b
=3,429 Å,
c
=5,086 Å; β=132,53°. - β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a
=4,21 Å, α=46,25°. - γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a
=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4 или O8, существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Уникальная инертность гелия
Неповторимость облика атома гелия
определяется сочетанием в нем двух удивительных природных конструкций – абсолютных чемпионов по компактности и прочности. В ядре гелия, гелия-4, насыщены обе внутриядерные оболочки – и протонная, и нейтронная. Электронный дублет, обрамляющий это ядро, тоже насыщенный. Орбиты двух электронов совершенно одинаковы и проходят предельно близко от ядра. Чтобы оголить ядро гелия, нужно затратить рекордно большую энергию – 78,61 МэВ. В этих конструкциях – ключ к пониманию свойств гелия. Отсюда проистекают и его феноменальная химическая инертность и рекордно малые размеры его атома.
Молекулы гелия неполярны
. Силы межмолекулярного взаимодействия между ними крайне невелики – меньше, чем в любом другом веществе. Отсюда – самые низкие значения критических величин, наинизшая температура кипения, наименьшие теплоты испарения и плавления. Что касается температуры плавления гелия, то при нормальном давлении ее вообще нет. Жидкий гелий при сколь угодно близкой к абсолютному нулю температуре не затвердевает, если, помимо температуры, на него но действует давление в 25 или больше атмосфер. Второго такого вещества в природе нет.
Реакция синтеза гелия – основа энергетической деятельности звезд
, их свечения. Следовательно, синтез гелия можно считать праотцом всех реакций в природе, первопричиной жизни, света, тепла и метеорологических явлений на Земле.
Гелий не всегда бывает конечным продуктом звездных синтезов. По теории профессора Д.А. Франк-Каменецкого, при последовательном слиянии ядер гелия образуются 3Be, 12C, 16O, 20Ne, 24Mg, а захват этими ядрами протонов приводит к возникновению других ядер. Для синтеза ядер тяжелых элементов вплоть до трансурановых требуются исключительные сверхвысокие температуры, которые развиваются на неустойчивых «новых» и «сверхновых» звездах.
А вот твердый гелий почти не изучен: велики экспериментальные трудности исследования этого самого холодного тела. Бесспорно, пробел этот будет заполнен, так как физики ждут много нового от познания свойств твердого гелия: ведь он тоже квантовое тело.
Звездный тигель
После долгих «темных веков» во Вселенной зажигаются первые звезды.


В их недрах при температуре около 10 миллионов градусов и плотности в несколько раз выше, чем у самого плотного металла на Земле, снова возникают условия для игры в алхимический конструктор — начинается звездный нуклеосинтез. Первое время эта игра весьма похожа на ту партию, что разыгрывалась сразу после рождения Вселенной. И все же некоторые отличия имеются. В звездном веществе вначале почти нет свободных нейтронов (в свободном состоянии они живут всего лишь около 15 минут), и поэтому дейтерий образуется при столкновении двух протонов. Один из них в процессе слияния превращается в нейтрон, испуская позитрон — положительно заряженную античастицу электрона, — чтобы избавиться от лишнего заряда. В отсутствие нейтронов из дейтерия не образуется тритий. Дейтерий довольно быстро соединяется с еще одним протоном и превращается в гелий-3. Прямой переход от него к гелию-4 путем захвата нейтрона, как в ранней Вселенной, невозможен, но тут имеется ряд обходных путей.
| В ядрах большинства звезд водород постепенно превращается в гелий. Фото PL/EAST NEWS |
Два ядра гелия-3 могут, столкнувшись, образовать крайне неустойчивое ядро бериллия-6 (4 протона + 2 нейтрона), которое мгновенно разваливается на гелий-4 и пару протонов. Другой вариант сложнее: в реакциях гелия-3 и гелия-4 рождаются ядра бериллия и лития с атомным весом 7. Однако, присоединяя еще один протон, они становятся неустойчивыми (помните — все ядра из 8 нуклонов крайне нестабильны) и сразу разваливаются на два ядра гелия-4. В общем, все дороги ведут в Рим.
Итогом любого из этих процессов становится превращение четырех протонов в одно ядро гелия-4. Важно, что масса ядра гелия-4 немного (примерно на 0,7%) меньше массы четырех протонов. Куда исчезает излишек массы? В соответствии все с той же формулой E = mc2 он превращается в энергию. Именно за счет этого, как говорят физики, дефекта массы и светят звезды. И, что немаловажно, звездный термоядерный реактор умеет сам себя регулировать: если выделяется слишком много энергии, звезда немного расширяется, вещество охлаждается и скорость реакции, которая очень сильно зависит от температуры, снижается. Если же энергии мало, то происходит обратный процесс. В итоге звезда стабильно поддерживает температуру на уровне, соответствующем достаточно низкому темпу реакций. Поэтому звезды (по крайней мере, некоторые из них) живут достаточно долго, чтобы хватило времени для биологической эволюции и появления столь высокоорганизованных существ, как мы с вами.
В конце концов запасы водорода в звезде исчерпываются. Надо двигаться дальше, а мы помним, что это непросто, поскольку не существует стабильных ядер с массой 5 и 8. Но природа находит выход. Вспоминая встречу одноклассников в метро, можно сказать, что хотя случайно столкнуться сразу троим крайне маловероятно, но если встретились двое и какое-то время едут вместе, то шансы, что по пути к ним добавится третий, увеличиваются. Нечто подобное происходит при ядерном горении гелия. В начале две альфа-частицы, сливаясь, образуют неустойчивое ядро бериллия-8. Жизнь его чрезвычайно коротка, 3.10-16 с (это меньше одной миллионной от одной миллиардной секунды), но при достаточно высокой плотности и температуре даже этого крошечного интервала хватает, чтобы иногда в реакцию с бериллием успела вступить еще одна альфа-частица. И — вуаля! — углерод-12 собственной персоной!
Затем уже углерод может захватывать альфа-частицы, давая кислород. Таким образом, два основных элемента, необходимых для появления жизни, рождаются в звездах. Превращение углерода в кислород идет настолько эффективно, что последнего во Вселенной оказывается даже несколько больше углерода. Если бы параметры ядерных частиц были чуть иными, то почти весь углерод «перегорал» бы в кислород, что делало бы жизнь в той форме, которую мы знаем, крайне редкой или даже невозможной. Может быть, в каких-то других вселенных частицы устроены несколько иначе и там углерода мало, но тогда там нет и наблюдателей (по крайней мере, подобных нам:)))).
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды
) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
4Li + O2 → 2Li2O 2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
2C6H6 + 15O2 → 12CO2 + 6H2O CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
CH3CH2OH + O2 → CH3COOH + H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды
со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 → Na2O2
- Некоторые оксиды поглощают кислород:
2BaO + O2 → 2BaO2
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
H2 + O2 → H2O2
- В надпероксидах
кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O− 2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
Na2O2 + O2 → 2NaO2
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
K + O2 → KO2
- Неорганические озониды
содержат ион O− 3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
3KOH + 3O3 → 2KO3 + KOH ∗ H2O + 2O2↑
- В ионе диоксигенила
O2+ кислород имеет формально степень окисления +½. Получают по реакции:
PtF6 + O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
- Дифторид кислорода
, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
2F2 + 2NaOH → 2NaF + H2O + OF2↑
- Монофторид кислорода
(
Диоксидифторид
), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
F2 + O2 → O2F2
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Как ученые определили, что железо — самый распространенный металл во Вселенной
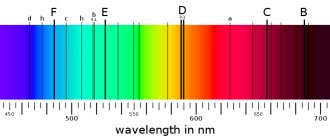
По сообщению журнала The Astrophysical Journal, группа астрохимиков из США пришла к такому выводу, рассчитав спектр поглощения кластеров железа. То есть ученые провели спектральный анализ удаленных объектов. Если не вдаваться в подробности, то объяснить это можно следующим образом. Когда мы что-либо видим, это означает, что от этого объекта отражается свет и мы улавливаем эти световые волны. Свет – это смесь электромагнитных колебаний, и каждое колебание имеет свою длину волны, и, соответственно, свой цвет. Есть 7 основных цветов, а также оттенков и переходов между ними. Когда проводится спектральный анализ, изучается именно то, как химические элементы поглащают или отражают свет. В итоге получается спектрограмма. На основе получившейся картины можно сделать вывод о характеристиках испустившего свет объекта. Простой пример — радуга после дождя. Капли дождя разделяют свет, исходящий от Солнца.
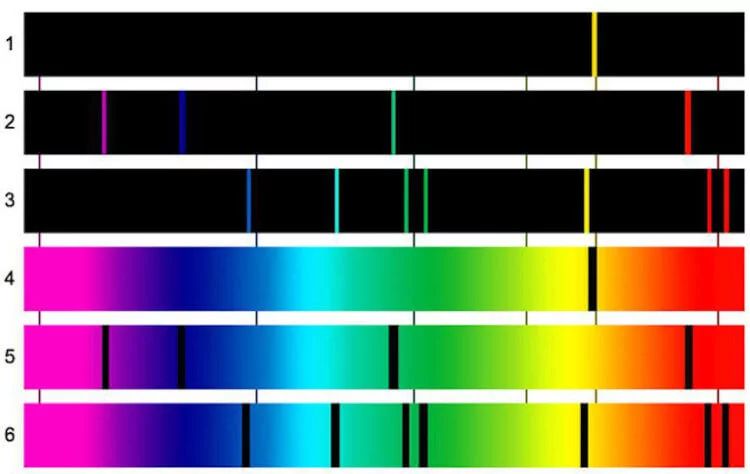

Спектрограмма. 1,4 — спектры натрия, 2,5 — спектры водорода, 3,6 — спектры гелия